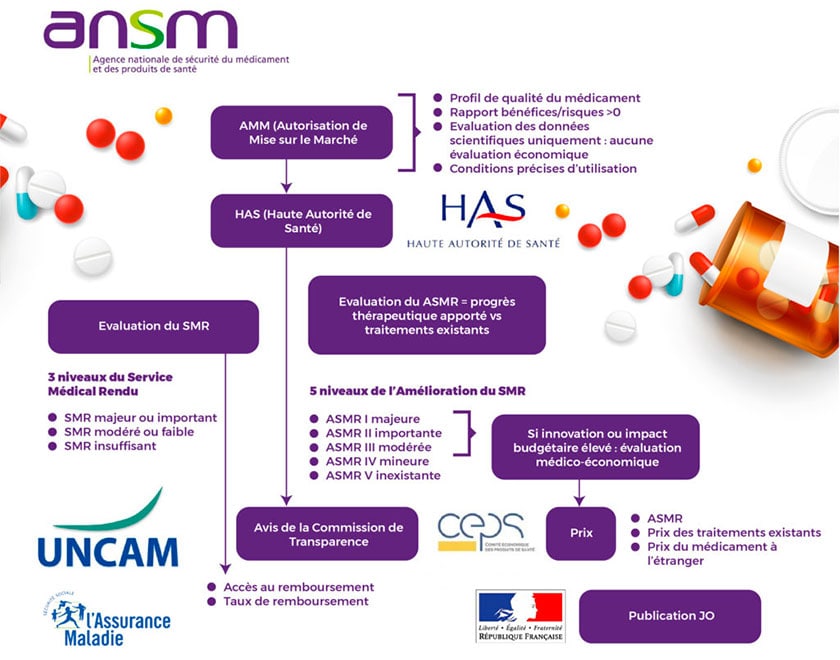
AMM : la première étape vers la commercialisation d’un médicament
En France pour être commercialisé un médicament a besoin d’une autorisation de mise sur le marché (AMM). Celle-ci est délivrée par l’ANSM (l’agence Nationale de Sécurité du Médicament et des produits de santé) ou l’EMA (European Medicines Agency). L’ANSM évalue la sécurité d’emploi, l’efficacité et la qualité des médicaments. Elle assure également la surveillance des évènements indésirables liés à leur utilisation.
Avant de se retrouver derrière le comptoir d’une pharmacie, un médicament passe par trois phases :
- Au début des travaux de recherche sont réalisés pour découvrir la molécule thérapeutique
- Par la suite des tests pré-cliniques sont effectués afin de connaître les effets de la toxicité de la molécule sur des modèles animaux, cellulaires et informatiques
- En dernier des essais cliniques sont accomplis sur des volontaires sains ou malades afin de s’assurer de la sécurité et de l’efficacité du médicament chez l’homme
De ce fait l’accès au marché du médicament est un long processus qui peut durer dix à quinze ans. Ces différentes phases sont strictement encadrés par la loi. Elles nécessitent cependant une autorisation préalable délivrée par l’ANSM.
De l’évaluation à l’autorisation de mise sur le marché (AMM)
Pour obtenir une AMM, les laboratoires pharmaceutiques doivent présenter à l’ANSM ou à l’EMA un dossier qui doit regrouper : les informations assemblées au cours des essais pré-cliniques et des essais cliniques. L’ANSM évalue le produit selon des critères scientifiques de qualité, de sécurité et d’efficacité: le nouveau produit doit présenter un rapport bénéfice/risque au moins équivalent à celui des produits déjà commercialisés.
Après l’évaluation scientifique, le dossier passe devant les commissions de l’Agence . Trois issues sont possibles :
- Avis favorable
- Demande de complément d’information
- Avis non favorable
Le directeur général de l’ANSM prend la décision d’autoriser ou non la mise sur le marché. L’AMM détient un accompagnement :
- Du Résumé des Caractéristiques du Produit (RCP)
- De la notice pour le patient
 L’admission au remboursement : évaluation par la HAS
L’admission au remboursement : évaluation par la HAS
La HAS (la Haute Autorité de Santé) évalue les nouveaux médicaments d’un point de vue clinique et médico-économique. Ses avis sont rendus aux pouvoirs publics permettent d’éclairer leur décision en vue d’une prise en charge par la solidarité nationale et de la négociation du prix de ces produits. Ainsi, la HAS , grâce à la commission de transparence (CT), évalue le service rendu des médicaments et apprécie leur progrès au regard des stratégies thérapeutiques existantes.
Deux critères évalués :
- Le SMR : Le Service Médical Rendu
- L’ASMR : l’Amélioration du Service Médical Rendu
Le SMR est un critère qui prend en compte plusieurs aspects :
- La gravité de la pathologie pour laquelle le médicament est indiqué
- Les données propres au médicament lui-même dans une indication donnée (efficacité, effets secondaires, intérêt pour la santé publique, stratégie thérapeutique)
3 niveaux du Service Médical Rendu existent :
- majeur ou important
- modéré ou faible mais justifiant cependant un remboursement
- insuffisant ou service médical rendu insuffisant pour justifier un remboursement
Notons que l’union nationale des caisses d’Assurance maladie (UNCAM) fixe le taux de remboursement d’un produit de santé compris entre 0 et 100 % sur la base du SMR.
Par la suite, la HAS va étudier l’ASMR (ou l’Amélioration du Service Médical Rendu) qui correspond au progrès thérapeutique apporté par un médicament, en comparaison avec les traitements disponibles dans une pathologie considérée. En fonction de l’appréciation de la Commission de Transparence, plusieurs niveaux d’ASMR ont été définis :
- I, majeure ;
- II, importante ;
- III, modérée ;
- IV, mineure ;
- V, inexistante, signifie « absence de progrès thérapeutique ».
AMM et fixation du prix
L’évaluation de l’amélioration du service médical rendu (ASMR), participe à la fixation du prix d’un médicament remboursable. Sur la base du niveau d’ASMR, le comité économique des produits de santé (CEPS) détermine le prix d’une innovation. C’est un organisme public qui regroupe une grande variété d’acteurs et décideurs institutionnels de la santé.
Ainsi la fixation du prix est obtenue, suite à une négociation entre le laboratoire pharmaceutique et le CEPS tout en prenant en compte plusieurs dimensions, dont l’ASMR, .
De plus la fixation du coût du médicament inclue également :
- Des traitements existants pour une pathologie donnée
- Des pratiques à l’étranger pour l’innovation considérée
Publication au Journal Officiel
Les trois étapes précédentes étant réalisées, la publication au journal officiel est l’étape ultime avant la commercialisation aux patients. Cette dernière comprend :
- L’inscription sur la liste des soins remboursables,
- Les avis de fixation du taux de remboursement
- Le prix publié de manière concomitante
À partir de ce moment, l’Assurance Maladie commercialise et rembourse le médicament.
Ainsi, les médicaments non remboursables sont directement commercialisables après l’AMM, aux prix industriel et officinal libres. Rappelons que le délai entre l’octroi de l’AMM et la commercialisation d’un produit, pour la France, est de 498 jours en moyenne.
Voici les différentes étapes entre l’obtention de l’AMM et la commercialisation des médicaments en France. N’hésitez pas à nous faire part de vos commentaires et restez connectés à notre blog. D’autres mises au point arriveront avec l’accès au marché et les donnés de vraie vie ! Stay tuned !

 L’admission au remboursement : évaluation par la HAS
L’admission au remboursement : évaluation par la HAS